Deus seja louvado
quarta-feira, 18 de outubro de 2017
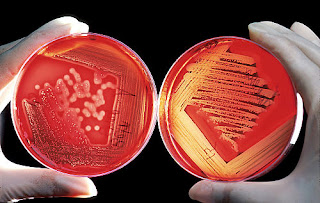
Ágar Sangue
PRINCÍPIO
O meio de Ágar sangue, usando uma base rica como abaixo descrita, oferece ótimas condições de
crescimento a maioria dos microrganismos. A conservação dos eritrócitos íntegros favorecem a
formação de halos de hemólise nítidos, úteis para a diferenciação de Streptococcus spp. e
Staphylococcus spp.
UTILIDADE
Usado para o isolamento de microrganismos não fastidiosos.
Verificação de hemólise dos Streptococcus spp. e Staphylococcus spp.
Usado na prova de satelitismo (para identificação presuntiva de Haemophilus spp.).
FÓRMULA / PRODUTO
FÓRMULA / PRODUTO
Meio comercial: Blood Ágar Base, Columbia Ágar Base, BHI Ágar, Mueller Hinton Ágar;
Sangue desfibrinado de carneiro ou coelho: 5 ml para cada 100 ml de meio base; pH: 6,8 +/- 0,2
PROCEDIMENTOS
Pesar e hidratar o meio conforme instruções do fabricante;
Esterilizar em autoclave;
Esfriar a base à +/- 50ºC;
Adicionar 5 ml de sangue desfibrinado de carneiro para cada 100 ml de base;
Homogeneizar delicadamente para não formar bolhas;
Distribuir em placas de Petri de 90 mm de diâmetro.
CONTROLE DE QUALIDADE
Hemólise beta hemolítica: Streptococcus pyogenes ATCC 19615 ou Staphylococcus aureus ATCC
25923.
Hemólise alfa hemolítica: Streptococcus do grupo viridans ou Streptococcus pneumoniae ATCC
6305.
Hemólise gama (sem hemólise): Enterococcus faecalis ATCC 29212 ou Staphylococcus epidermidis
ATCC 12228.
CONSERVAÇÃO E VALIDADE
Conservar de 4 a 10°C por 4 meses.
INOCULAÇÃO
Estriar a superfície do meio, usando a técnica de semeadura para isolamento;
No final da semeadura, picar o meio com a alça para verificar hemólise em profundidade;
Incubar à 35ºC 24 horas.
INTERPRETAÇÃO
Cor original do meio: vermelho.
Beta hemólise: presença de halo transparente ao redor das colônias semeadas (lise total dos
eritrócitos).
Alfa hemólise: presença de halo esverdeado ao redor das colônias semeadas (lise parcial dos
eritrócitos).
Gama hemólise (sem hemólise): ausência de halo ao redor das colônias (eritrócitos permanecem
íntegros).
RECOMENDAÇÕES
Não usar sangue de carneiro vencido, pois o meio fica hemolisado ou com cor muito escura,
dificultando o estudo de hemólise;
Não usar sangue humano, pois alguns microrganismos não apresentam hemólise;
Não adicionar o sangue na base do meio quente, pois as hemácias rompem-se, dificultando o
estude de hemólise;
Por ser um meio rico, o crescimento a partir de materiais biológicos em geral costuma ser abundante,
sempre que necessário, isolar a colônia em estudo para os procedimentos de identificação, para não
correr o risco de trabalhar com cepas misturadas.
Deus seja louvado
segunda-feira, 16 de outubro de 2017
Ágar Chocolate
ÁGAR CHOCOLATE
PRINCÍPIO
Observação: se utilizar sangue de carneiro ou coelho no lugar do sangue de cavalo, adicionar os suplementos a base de NAD (coenzima I) e cisteína após resfriar a base achocolatada à aproximadamente 50ºC.
UTILIDADE
Crescimento de microrganismos exigentes Haemophilus spp., Neisseria spp., Branhamella catarrhalis e Moraxella spp.
FÓRMULA / PRODUTO
CONTROLE DE QUALIDADE
Crescimento bom a excelente: Haemophilus influenzae ATCC 10211.
CONSERVAÇÃO E VALIDADE
Conservar de 4 a 10°C por 4 meses.
INOCULAÇÃO
Estriar a superfície do meio, usando a técnica de semeadura para isolamento;
Incubar a 35ºC por 24 horas.
INTERPRETAÇÃO
Cor original do meio: castanho escuro (chocolate).
Colônias de tamanho pequeno a médio, com pigmento amarelo: sugestivo de Neisseria spp, Branhamella catarrhalis ou Moraxella spp.
Colônias pequenas e delicadas, com pigmento creme claro: sugestivo de Haemophilus spp.
RECOMENDAÇÕES
Deus seja louvado
PRINCÍPIO
Meio de Ágar Chocolate é amplamente utilizado para o cultivo de microrganismos exigentes,
embora cresçam neste meio quase todos os tipos de microrganismos.
À base do meio, é adicionado sangue de cavalo, carneiro ou coelho em temperatura alta, o que faz
com que as hemácias lisem, liberando hemina e hematina, compostos fundamentais para o
crescimento dos microrganismos exigentes.
Observação: se utilizar sangue de carneiro ou coelho no lugar do sangue de cavalo, adicionar os suplementos a base de NAD (coenzima I) e cisteína após resfriar a base achocolatada à aproximadamente 50ºC.
UTILIDADE
Crescimento de microrganismos exigentes Haemophilus spp., Neisseria spp., Branhamella catarrhalis e Moraxella spp.
FÓRMULA / PRODUTO
Meios comerciais: BHI Ágar *, Columbia Ágar Base, Blood Ágar Base, Mueller Hinton Ágar.
Sangue de cavalo, carneiro ou coelho desfibrinado.
Recomenda-se o uso da base de BHI Ágar, por apresentar melhor crescimento das cepas
exigentes, principalmente cepas de Haemophilus spp.
PROCEDIMENTOS
Pesar e hidratar o meio conforme instruções do fabricante;
Esterilizar em autoclave;
Esfriar a base à temperatura de aproximadamente 80ºC;
Adicionar 5 ml de sangue desfibrinado de cavalo para cada 100 ml de base;
Homogeneizar bem até lisar totalmente as hemácias e o meio apresentar uma cor castanho escuro
(chocolate);
Distribuir em placas de Petri de 90 mm de diâmetro.
Crescimento bom a excelente: Haemophilus influenzae ATCC 10211.
CONSERVAÇÃO E VALIDADE
Conservar de 4 a 10°C por 4 meses.
INOCULAÇÃO
Estriar a superfície do meio, usando a técnica de semeadura para isolamento;
Incubar a 35ºC por 24 horas.
INTERPRETAÇÃO
Cor original do meio: castanho escuro (chocolate).
Colônias de tamanho pequeno a médio, com pigmento amarelo: sugestivo de Neisseria spp, Branhamella catarrhalis ou Moraxella spp.
Colônias pequenas e delicadas, com pigmento creme claro: sugestivo de Haemophilus spp.
RECOMENDAÇÕES
Lembrar que é um meio rico e crescem vários tipos de microrganismos.
Fazer esfregaço de todas as colônias suspeitas e corar pela técnica de Gram, para confirmar se
trata-se ou não de Neisseria spp., Branhamella catarrhalis ou Moraxella spp. (cocos Gram
negativos reniformes) ou Haemophilus spp. (bacilos Gram negativos delicados e pleomérficos).
Não usar sangue de cavalo vencido.
Por ser um meio rico, o crescimento a partir de materiais biológicos em geral costuma ser
abundante. Sempre que necessário, isolar a colônia em estudo para os procedimentos de
identificação, para não correr o risco de trabalhar com cepas misturadas .
Deus seja louvado
Ancylostoma duodenale
O parasito Ancylostoma duodenale faz parte do Reino Metazoa, Filo Nematoda, Classe
Secernentea, Ordem Strongylida, Família Ancylostomatidae. Os parasitos
apresentam dimorfismo sexual alem de duas estruturas bastantes características:
cápsula bucal, nas fêmeas e machos, e bolsa copuladora, nos machos. O Ancylostoma duodenale parasita o intestino delgado ingerindo sangue do
hospedeiro. O parasito adulto se fixa, através dos dentes, na mucosa do
intestino delgado do hospedeiro. As fêmeas fazem ovoposição de milhares de
ovos, os eliminando nas fezes do hospedeiro. Os ovos do Ancylostoma duodenale são bastante característicos, as larvas rabditóide do
primeiro estádio, são chamadas L1, eclodindo entre 24 e 48 horas após o ovo entrar
em contato com o meio externo. A larva L1 sofre transformação para larva
rabditóide L2. Após nova muda e surge a larva L3. O desenvolvimento do ovo até
a larva L3 ocorre de cinco a oito dias. A infecção intestinal ocorre após a
penetração das larvas L3 através na pele ou pela ingestão das mesmas, a segunda
via mais eficiente para iniciar a patologia.
Na infecção por
via oral, o hospedeiro ingere as larvas L3, as larvas perdem sua cutícula na
passagem pelo estômago. Após três dias de infecção as larvas migram para o
intestino invadindo a mucosa intestinal, sofrendo muda para larva L4, as larvas
L4 migram para o lúmen do intestino delgado, onde transforma em adultos jovens,
fixando à mucosa intestinal realizando hematofagia e posterior cópula.
Nas infecções
percutâneas, as larvas L3 penetram na pele através dos folículos pilosos,
chegando aos vasos sangüíneos e/ou linfáticos.
Uma vez na circulação sanguínea, as larvas L3 são levadas
para a microcirculação pulmonar, penetrando nos alvéolos, passando pelo sistema
respiratório, sendo expelidas ou deglutidas. As larvas L3 durante a passagem
pelo sistema respiratório sofrem a muda para estagio larval L4.
Após chegarem ao
sistema digestivo passando pelo estômago e chegando ao intestino delgado, as
larvas desenvolvem em vermes adultos, alimentando e se reproduzindo. Alternativamente, as larvas L3 podem adentrar
na circulação sistêmica migrando pelos tecidos (migração somática), ficando
instaladas nas fibras musculares esqueléticas como larvas L3 hipobióticas
(dormentes).
A ancilostomose
em humanos é uma grave patologia acometendo milhões de pessoas em regiões
tropicais e subtropicais. A patogenia
causada pelo Ancylostoma
duodenale é uma consequência direta da perda
sanguínea, ocasionado pela fixação e alimentação do Ancylostoma duodenale na mucosa intestinal.
Em algumas regiões países a
Ancilostomose é a principal causadora da perda de sanguínea
intestinal, anemia por deficiência de ferro e desnutrição protéica, dependendo
do estado nutricional do hospedeiro e da carga parasitária, a parasitose pode
causar retardo mental e físico, óbitos em crianças e danos à saúde
materno-fetal em gestantes. O diagnóstico da
parasitose é feito através detecção de ovos nas fezes, porem vale ressaltar que os ovos do Ancylostoma duodenale e muito semelhantes a de outros estrongilídeos. Como
alternativamente, o método de coprocultura desenvolvimento de larvas L3 a
partir dos ovos – pode ser utilizado. O tratamento é feito com uso das drogas
anti-helmínticas, como albendazol, mebendazol, pamoato de pirantel e/ou
levamisol.
Deus seja louvado
domingo, 15 de outubro de 2017
Estrongiloidíase humana
A patologia estrongiloidíase
humana é uma helmitose provocada por nematóide intestinal pertencente ao gênero
strongyloides, o parasito é geoelminto pertencente à família Rhabdiasidae. A
patogênese inicia com a penetração da larva infectante na pele do hospedeiro,
após a penetração a penetração a larva realiza um ciclo cardiopulmonar. Pode
ocorrer também a transmissão oral e auto infecção.
A forma adulta parasitária é
fêmea partenogenética que mede entre 1,7 a 2,5 mm. As larvas infectantes do
parasita Strongyloides stercoralis presente no solo, penetram na pele e chegam
aos pulmões, traquéia e epiglote, logo após são deglutidas atingindo o trato
digestivo transformando-se em parasitos adulto. Após a liberação dos ovos
larvados, os ovos eclodem no intestino liberando larvas rabitoides (não
infectante), que são expelidas nas fezes.
No ambiente externo, as larvas
rabditoides evoluem para filarioide (forma infectante), porem podem evoluir
para vermes adultos de vida livre, após a copula os parasitas adultos de vida
livre geram novas formas infectantes.
Outras formas de infecção é
transmissão fecal-oral, ingestão de água ou alimentos contaminados. Alem das
formas citadas, podem ocorrer autoinfecção externa e interna, a forma externa ocorre
quando as larvas penetram na mucosa retal, a interna ocorre no intestino em
situação propicia a transformação das larvas em formas infectantes.
O período entre a larva infectante
penetrando a pele é o surgimento das larvas não infectantes nas fezes ocorre
entre 14-18 dias, já a manifestação clinica varia de paciente para paciente. A
estrongiloidiase na maioria dos pacientes é assintomática, as formas
sintomáticas podem causar dermatológicas, pulmonares e intestinais. As lesões
dermatológicas apresentam quadros urticariformes, maculopapulares,
Serpiginosas, que são secundários a penetração das larvas na pele. As
manifestações pulmonares são tosse seca, dispnéia, bronco espasmos e edema
pulmonar, cursando para eosinofilia elevada. No intestino as manifestações são;
flatulência, cólica, anorexia, náusea, vômitos e diarréia. Em pacientes com
imunossupressão, a doença pode ser fatal em decorrência da disseminação para
vários órgãos. O diagnostico se da identificando as larvas em amostras fecal.
As técnicas mais utilizadas são o exame direto utilizando solução salina e
lugol, Baermann-Moraes, sedimentação, cultura em placa de Ágar e Harada-Mori.
Em quadros de infecção disseminada, é possível encontrar as larvas nos diversos
fluidos corpóreos. O tratamento é feito com as drogas; Tiabendazol, Ivermectina
ou Albendazol.
Deus seja louvado
Ascaris lumbricóides
O parasito Ascaris lumbricóides é
um helminto conhecido no meio clinico e popular, pela sua grande distribuição
geográfica e danos causados nos hospedeiros. O parasito é denominado Lombriga
ou Bicha, a patologia casada é denominada ascaridíase, ascaridose ou ascariose.
O parasito adulto são grandes: os vermes machos tem de 15 a 30 cm e fêmeas de
20 a 50 cm de comprimentos.Porem deve-se ressaltar que o tamanho do parasito
depende da quantidade de parasitos albergados no paciente , além do estado
nutricional do mesmo.
Os ovos do parasita são brancos
porem adquire pigmentação castanha após contato com fezes. Os ovos são grandes,
medindo aproximadamente 50 um, sendo ovais e com cápsula espessa, em decorrência
da membrana externa mamilonada. Os ovos apresentam massa de células
germinativas. As fêmeas após copula eliminam aproximadamente 200000 ovos
diariamente, os ovos tornam-se infectantes aproximadamente um mês após contato
com solo e são infecciosos por vários meses. As fêmeas podem produzir ovos
inférteis em infecções sem o parasita macho.
A ascaridíase é prevalente e
endêmica em regiões onde o saneamento básico e tratamento dos dejetos humanos
são precárias, alem de locais onde o esgoto humano é utilizado na fertilização.
O primeiro estagio de
desenvolvimento do parasito e a larva L1, a larva L1 é rabiditoide, pois possui
duas dilatações no esôfago em ambas extremidades e uma constrição no meio. A
larva L1 transforma em L2 aproximadamente uma semana após o inicio do ciclo.
Logo após a larva L2 sofre muda para o estagio L3 que é o estagio infectante. A
larva L3 é filarióide, pois tem o esôfago retilíneo.
Após o paciente ingerir os ovos
larvados em estagio L3, os ovos eclodem no intestino delgado, as larvas perfuram
a parede intestinal caindo nos vasos linfáticos e veias, invadindo o fígado.
Logo após chegam ao coração pela veia Cava, seguindo para os pulmões. Após as
larvas sofrerem muda para estagio L4 elas rompem os capilares e caem nos alvéolos,
sofrendo nova transformação para estagio L5, subindo pela traquéia chegam à
faringe onde são deglutidas, fixando no intestino delgado, transformando-se em
jovens adultos, após chegar à maturidade sexual fazem a cópula e ovipostura,
eliminando ovos nas fezes para completar o ciclo.
A ingestão de poucos ovos não
produz sintomas clínicos, porem um único parasito adulto pode perfurar o
intestino causando infecção bacteriana secundaria, alem de possível migração
para o bucto biliar e fígado. A migração dos parasitos para os pulmões
ocasionam pneumonite semelhante a ataque de Asma (tosse, eosinofilia e
infiltrado pulmonar). Quando presente em grandes quantidades os parasitas podem
pode provocar grave obstrução mecânica no intestino.
Geralmente a ascaridíase e
assintomática dificultando o diagnostico clinico, o diagnostico laboratorial é
feito pela pesquisa dos ovos nas fezes, a técnica mais utilizada é a
sedimentação espontânea, porem o método de Kato modificado por Katzé
recomendada para realização de inquéritos epidemiológicos.
A OMS recomenda o uso de quatro
drogas no tratamento da ascaridíase, Albendazol, Mebendazol, Levamisol e
Pamoato de Pirantel.
Deus seja louvado
Assinar:
Postagens (Atom)
Curso de Bioestatística- Parte 1
Estatística #01 Estatística #02 ( População, Censo e Amostra) Estatística #03 (aspectos dos dados) Estatística #04 - Tabela de Frequ...

-
ÁGAR NUTRIENTE PRINCÍPIO: O Nutriente Ágar é um meio relativamente simples, de fácil preparação e barato, muito usado nos procediment...
-
Leucócitos Os leucócitos encontrados na urina são esféricos, com cor amarelo-esverdeado ou cinza. Em urinas normais pode ser encon...
-
Resolução nº 190, 10/12/10 do CFBM • Monitorar e prevenir riscos de natureza química, física e biológica inerentes aos procedimento...